A. Cách làm hóa học với tính theo công thức hóa học
I. Lập cách làm hóa học tập của phù hợp chất lúc biết hóa trị
Các cách để xác minh hóa trị
Bước 1: Viết bí quyết dạng Ax
By
Bước 2: Đặt đẳng thức: x . Hóa trị của A = y . Hóa trị của B
Bước 3: biến đổi thành tỉ lệ:

= Hóa trị của B/ Hóa trị của A
Chọn a’, b’ là hồ hết số nguyên dương và tỉ lệ b’/a’ là buổi tối giản => x = b (hoặc b’); y = a (hoặc a’)
Ví dụ: Lập phương pháp hóa học của hợp chất sau: C (IV) với S (II)
Bước 1: công thức hóa học của C (IV) cùng S (II) bao gồm dạng

Bước 2: Biểu thức quy tắc hóa trị: x.IV = y.II
Chuyển thành tỉ lệ:

Bước 3: công thức hóa học yêu cầu tìm là: CS2
Bài tập vận dụng:
Bài tập 1: Lập bí quyết hóa học và tính phân tử khối của các hợp chất tạo vì một nguyên tố và nhóm nguyên tử sau:
a. Tía (II) và nhóm (OH)
b. Cu (II) với nhóm (SO4)
c. Sắt (III) cùng nhóm (SO4)
Bài tập số 2: Trong các công thức hoá học sau đây, phương pháp hoá học nào sai? Sửa lại mang đến đúng: Fe
Cl , Zn
O2 , KCl , Cu(OH)2 , Ba
S, Cu
NO3 , Zn2OH, K2SO4 , Ca2(PO4)3, Al
Cl, Al
O2, K2SO4, HCl, Ba
NO3, Mg(OH)3 Zn
Cl, Mg
O2, Na
SO4, Na
Cl, Ca(OH)3, K2Cl, Ba
O2, Na
SO4, H2O, Zn(NO3)2, Al(OH)2, NaOH2, SO3, Al(SO4)2.
Bạn đang xem: Tuyển tập 40 bài tập hóa học nâng cao lớp 8
Bài tập 3: Lập cách làm hóa học của những hợp hóa học sau:
a. C (IV) cùng S (II)
b. Sắt (II) cùng O.
c. P (V) với O.
d. N (V) cùng O.
Bài tập số 4: Lập phương pháp hoá học của những hợp chất sau cùng tính phân tử khối:
| a/ Cu và O | b/ S(VI) cùng O | c/ K và (SO4) |
| d/ Ba và (PO4) | e/ Fe(III) và Cl | f/ Al cùng (NO3) |
| g/ P(V) với O | h/ Zn với (OH) | k/ Mg cùng (SO4) |
| l/ Fe(II) cùng (SO3) | m/ Ca với (CO3) |
II. Tính yếu tố % theo trọng lượng của những nguyên tố trong hợp hóa học Ax
By
Cz
Cách 1.
+ Tìm khối lượng mol của vừa lòng chất
+ search số mol nguyên tử mỗi nguyên tố trong một mol hợp chất rồi quy về khối lượng
+ kiếm tìm thành phần xác suất các thành phần trong vừa lòng chất
Cách 2. Xét cách làm hóa học: Ax
By
Cz

Hoặc %C = 100% - (%A + %B)
Ví dụ: Photphat tự nhiên và thoải mái là phân lân không qua chế đổi khác học, thành phần chính là canxi photphat tất cả công thức hóa học là Ca3(PO4)2
Bước 1: Xác định cân nặng mol của hợp chất.
MCa3(PO4)2 = 40.3 + 31.2 + 16.4.2 = 310 g/mol
Bước 2: xác định số mol nguyên tử của từng nguyên tó trong một mol hòa hợp chất
Trong 1 mol Ca3(PO4)2 có: 3 mol nguyên tử Ca, 2 mol nguyên tử p và 8 mol nguyên tử O
Bước 3: Tính yếu tắc % của từng nguyên tố.

Bài tập vận dụng
Bài tập số 1: Tính thành phần phần trăm (theo khối lượng) của các nguyên tố hóa học có mặt trong những hợp chất sau:
a. Fe(NO3)2, Fe(NO3)2
b. N2O, NO, NO2
Bài tập số 2: Phân đạm urê, có công thức hoá học tập là (NH2)2CO. Phân đạm có mục đích rất đặc biệt quan trọng đối với cây trồng và thực thứ nói chung, nhất là cây lấy lá như rau.
a. Khối lượng mol phân tử ure
b. Hãy xác minh thành phần tỷ lệ (theo khối lượng) của các nguyên tố
III. Lập phương pháp hóa học của phù hợp chất khi biết thành phần phần trăm (%) về khối lượng
Các bước xác minh công thức chất hóa học của vừa lòng chất
+ cách 1: Tìm cân nặng của mỗi nguyên tố có trong một mol hợp chất.
+ bước 2: tìm kiếm số mol nguyên tử của nguyên tố có trong 1 mol hợp chất.
+ cách 3: Lập phương pháp hóa học tập của thích hợp chất.

Ví dụ: Một hợp chất khí có thành phần % theo khối lượng là 82,35%N và 17,65% H. Khẳng định công thức chất hóa học của hóa học đó. Biết tỉ khối của hợp hóa học khí với hidro bằng 8,5.
Hướng dẫn giải
Khối lượng mol của hợp chất khí bằng: M = d,MH2 = 8.5,2 = 17 (gam/mol)
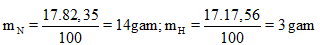
Số mol nguyên tử của mỗi nguyên tố trong 1 mol phù hợp chất:

Trong 1 phân tử hợp hóa học khí bên trên có: 1mol nguyên tử N với 3 mol nguyên tử H.
Công thức chất hóa học của hợp hóa học trên là NH3
Bài tập vận dụng
Bài tập số 1: Một phù hợp chất có thành phần những nguyên tố theo trọng lượng là: 40% Cu; 20% S và 40%O. Xác minh công thức hóa học của chất đó. Biết hợp hóa học có trọng lượng mol là 160g/mol.
Bài tập số 2: Hãy tìm công thức hóa học tập của hóa học X có khối lượng mol MX = 170 (g/mol), thành phần các nguyên tố theo khối lượng: 63,53% Ag; 8,23% N, còn sót lại O.
IV. Lập công thức hóa học nhờ vào tỉ lệ cân nặng của các nguyên tố.
1. Bài xích tập tổng quát: Cho một thích hợp chất gồm 2 yếu tố A cùng B tất cả tỉ lệ về khối lượng là a:b Hay

. Tìm phương pháp của đúng theo chất
2. Phương thức giải
Gọi bí quyết hóa học tổng thể của 2 nguyên tố gồm dạng là Ax
By. (Ở đây họ phải đi tìm được x, y của A, B. Tra cứu tỉ lệ: x:y => x,y)
=> CTHH
Ví dụ: Tìm cách làm hóa học của một oxit sắt, biết tỷ lệ cân nặng của sắt cùng oxi là 7:3
Gọi bí quyết hóa học tập của oxit sắt yêu cầu tìm là: Fex
Oy
Ta có:
CTHH: Fe2O3
Bài tập vận dụng
Bài tập số 1: Một đúng theo chất bao gồm tỉ lệ trọng lượng của các nguyên tố Ca:N:O theo lần lượt là 10:7:24. Xác định bí quyết hóa học của hợp hóa học biết N với O có mặt nhóm nguyên tử, với trong nhóm tỉ lệ số nguyên tử của N: O = 1:3.
Bài tập số 2: Tìm phương pháp hóa học của một oxit nito, biết tỉ lệ trọng lượng của nito đối với oxi là 7:16. Tìm cách làm của oxit đó
B. Phương trình hóa học. Tính theo phương trình hóa học.
I. Phương trình hóa học
1. Cân đối phương trình hóa học
a) Cu
O + H2 → Cu
O
b) CO2 + Na
OH → Na2CO3 + H2O
c) Zn + HCl → Zn
Cl2 + H2
d) Al + O2 →Al2O3
e) Na
OH + Cu
SO4 → Cu(OH)2 + Na2SO4
f) Al2O3 + Na
OH → Na
Al
O2 + H2O
g) Fe(OH)3 → Fe2O3 + H2O
h) H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
i) Ba
Cl2 + Ag
NO3 → Ag
Cl + Ba(NO3)2
k) Fe
O + H2SO4 → Fe2(SO4)3 + SO2 + H2O
2. Dứt các phương trình hóa học sau:
1) Photpho + khí oxi →Photpho(V) oxit (P2O5)
2) Khí hiđro + oxit fe từ (Fe3O4) → sắt + Nước
3) Kẽm + axit clohidric → kẽm clorua + hidro
4) canxi cacbonat + axit clohidric → can xi clorua + nước + khí cacbonic
5) fe + đồng (II) sunfat → sắt (II) sunfat + đồng
3. Chọn CTHH phù hợp đặt vào phần nhiều chỗ gồm dấu chấm hỏi và cân bằng các phương trình chất hóa học sau:
1) Ca
O + HCl →?+ H2
2) p + ? → P2O5
3) Na2O + H2O →?
4) Ba(NO3)2 + H2SO4 → Ba
SO4 + ?
5) Ca(HCO3)2 → Ca
CO3 + CO2 + ?
6) Ca
CO3 + HCl → Ca
Cl2 + ? + H2O
7) Na
OH + ? → Na2CO3 + H2O
4. Cân bằng các phương trình hóa học sau chứa ẩn
1) Fex
Oy + H2 → fe + H2O
2) Fex
Oy + HCl → Fe
Cl2y/x + H2O
3) Fex
Oy + H2SO4 → Fe2(SO4)2y/x + H2O
4) M + H2SO4 → M2(SO4)n + SO2 + H2O
5) M + HNO3 → M(NO3)n + NO + H2O
6) Fex
Oy + H2SO4 → Fe2(SO4)2y/x + SO2 + H2O
II. Tính theo phương trình hóa học
Các công thức đo lường và thống kê hóa học nên nhớ
Trong đó:
n: số mol của chất (mol)
m: khối lượng (gam)
M: cân nặng mol (gam/mol)
=>
V: thề tích hóa học (đktc) (lít)
Ví dụ: Đốt cháy trọn vẹn 13 gam Zn vào oxi chiếm được Zn
O.
a) Lập PTHH.
b) Tính trọng lượng Zn
O thu được?
c) Tính cân nặng oxi sẽ dùng?
Lời giải
a) PTHH: 2Zn + O2 → 2Zn
O
b) Số mol Zn là: n
Zn = 13/65 = 0,2mol
PTHH: 2Zn + O2 → 2Zn
O
Tỉ lệ PT: 2mol 1mol 2mol
0,2mol ? mol ? mol
Số mol Zn
O tạo thành thành là: n
Zn
O = (0,2.2)/2= 0,2mol
=> trọng lượng Zn
O là: m
Zn
O = 0,2 . 81 = 16,2 gam
c) Số mol khí O2 đã sử dụng là: n
O2= (0,2.1)/2 = 0,1mol
=> khối lượng O2 là: m
O2 = n.M = 0,1.32 = 3,2gam
Bài tập củng cố
Bài tập số 1: Đốt cháy trọn vẹn 1,12 lít CH4. Tính thể tích oxi đề nghị dùng cùng thể tích khí CO2 tạo thành (đktc).
Bài tập số 2: Hòa tan trọn vẹn 6,75 gam kim loại nhôm trong hỗn hợp axit clohidric HCl dư. Làm phản ứng hóa học giữa nhôm cùng axit clohidric HCl được màn trình diễn theo sơ vật sau:
Al + HCl → Al
Cl3 + H2
a) Hãy lập phương trình hóa học của làm phản ứng.
b) Tính thể tích(ở đktc) của khí H2 sinh ra.
c) Tính khối lượng axit HCl vẫn tham gia bội phản ứng.
d) Tính khối lượng muối Al
Cl3 được tạo thành.
Bài tập số 3: Biết rằng 2,3 gam một kim loại R (có hoá trị I) chức năng vừa đầy đủ với 1,12 lit khí clo (ở đktc) theo sơ đồ p/ư:
R + Cl2 ---> RCl
a) khẳng định tên sắt kẽm kim loại R
b) Tính khối lượng hợp hóa học tạo thành
III. Bài toán về lượng chất dư
Giả sử tất cả phản ứng hóa học: a
A + b
B ------- > c
C + d
D.
Cho n
A là số mol chất A, và n
B là số mol hóa học B
Tính lượng những chất theo hóa học phản ứng hết.
Ví dụ. Cho 6,5 gam kẽm chức năng với 36,5 g dung dịch HCl. Tính cân nặng muối tạo thành sau phản ứng.
Zn + 2HCl → Zn
Cl2 + H2Theo phương trình: 1 mol 2 mol 1 mol
Theo đầu bài bác : 0,1 mol 0,1 mol 0,05 mol
Xét tỉ lệ:
→ Zn dư, cân nặng các chất tính theo lượng HCl
Bài tập vận dụng:
Bài tập số 1: Cho một lá nhôm nặng nề 0,81g dung dịch đựng 2,19g HCl
a) hóa học nào còn dư, và dư từng nào gam
b) Tính cân nặng các hóa học thu được sau bội phản ứng là?
Bài tập số 2: Khi cho miếng nhôm tan không còn vào hỗn hợp HCl bao gồm chứa 0,2 mol thì có mặt 1,12 lít khí hidro (đktc).
Tính khối lượng miếng nhôm vẫn phản ứngAxit clohidric còn dư hay không? nếu như còn dư thì khối lượng dư là bao nhiêu?
C. Dung dịch với nồng độ dung dịch
I. Các công thức buộc phải ghi nhớ
1. Độ tan
2. Nồng độ tỷ lệ dung dịch (C%)
Trong đó:
mct: trọng lượng chất rã (gam)
mdd: trọng lượng dung dịch (gam)
Ví dụ: Hòa tan 15 gam muối hạt vào 50 gam nước. Tình nồng độ tỷ lệ của dung dịch thu được:
Hướng dẫn giải:
Ta có: mdd = mdm + mct = 50 + 15 = 65 gam
Áp dụng công thức:
3. Nồng độ mol hỗn hợp (CM)
Ví dụ: Tính nồng độ mol của dung dịch khi 0,5 lit dung dịch Cu
SO4 chứa 100 gam Cu
SO4
Hướng dẫn giải:
Số mol của Cu
SO4 = 100 : 160 = 0,625 mol
Nồng độ mol của dung dịch Cu
SO4 = 0,625 : 0,5 = 1,25M
4. Công thức tương tác giữa D (khối lượng riêng), mdd (khối lượng dung dịch) cùng Vdd (thể tích dung dịch):
II. Những dạng bài xích tập
Dạng I: bài bác tập về độ tan
Bài tập số 1: Ở 20o
C, 60 gam KNO3 tan vào 190 nước thì thu được hỗn hợp bão hoà. Tính độ rã của KNO3 ở ánh nắng mặt trời đó ?
Bài tập số 2: ở 20o
C, độ chảy của K2SO4 là 11,1 gam. Buộc phải hoà tan bao nhiêu gam muối hạt này vào 80 gam nước thì thu được hỗn hợp bão hoà ở nhiệt độ đã mang đến ?
Bài tập số 3: Tính cân nặng KCl kết tinh đợc sau khi làm nguội 600 gam dung dịch bão hoà ngơi nghỉ 80o
C xuống 20o
C. Biết độ chảy S nghỉ ngơi 80o
C là 51 gam, nghỉ ngơi 20o
C là 34 gam.
Dạng II: pha trộn dung dịch xẩy ra phản ứng giữa các chất rã với nhau hoặc phản nghịch ứng giữa chất tan với dung môi → Ta yêu cầu tính mật độ của sản phẩm (không tính độ đậm đặc của chất tan đó).
Ví dụ: Khi mang đến Na2O, Ca
O, SO3... Vào nước, xảy ra phản ứng:
Na2O + H2O →2Na
OH
Ca
O + H2O →Ca(OH)2
Bài tập số 1: mang đến 6,2 gam Na2O vào 73,8 gam nước thu được hỗn hợp A. Tính nồng độ của chất có trong dung dịch A ?
Bài tập số 2: Cho 6,2 gam Na2O vào 133,8 gam hỗn hợp Na
OH gồm nồng độ 44,84%. Tính nồng độ phần trăm của chất gồm trong dung dịch ?
Bài tập số 3: buộc phải cho thêm a gam Na2O vào 120 gam dung dịch Na
OH 10% để được dung dịch Na
OH 20%. Tính a ?
Dạng III: trộn lẫn hai dung dịch cùng một số loại nồng độ cùng nhiều loại chất tan.
Bài toán 1: Trộn m1 gam dung dịch hóa học A bao gồm nồng độ C1% với m2 gam dung dịch chất A gồm nồng độ C2 % →Được dung dịch mới có cân nặng (m1+ m2) gam cùng nồng độ C%.
- phương pháp giải:
Áp dụng công thức:
Ta tính khối lượng chất tan gồm trong dung dịch 1 (mchất tan dung dịch 1) và cân nặng chất tan có trong hỗn hợp 2 (mchất tan hỗn hợp 2) → trọng lượng chất tan tất cả trong hỗn hợp mới
→ mchất tan dung dịch mới = mchất tan hỗn hợp 1 + mchất tan hỗn hợp 2 = m1.C1% + m2C2%
Dạng III: trộn lẫn hai dung dịch cùng một số loại nồng độ cùng nhiều loại chất tan.
Bài toán 1: Trộn m1 gam dung dịch chất A tất cả nồng độ C1% với m2 gam dung dịch chất A gồm nồng độ C2 % →Được dung dịch bắt đầu có cân nặng (m1+ m2) gam cùng nồng độ C%.
- phương pháp giải:
Áp dụng công thức:
Ta tính trọng lượng chất tan gồm trong dung dịch 1 (mchất tan dung dịch 1) và khối lượng chất tan có trong hỗn hợp 2 (mchất tan dung dịch 2) → trọng lượng chất tan có trong dung dịch mới
→ mchất tan dung dịch new = mchất tan dung dịch 1 + mchất tan hỗn hợp 2 = m1.C1% + m2C2%
Dạng III: Trộn 2 dung dịch những chất tan bội phản ứng với nhau
1. Phương thức giải:
Tính số mol những chất trước phản nghịch ứng. Viết phương trình bội nghịch ứng khẳng định chất chế tác thành.
Tính số mol những chất sau làm phản ứng.
Tính khối lượng, thể tích dung dịch sau phản nghịch ứng.
Tính theo yêu ước của bài bác tập.
2. Cách tính khối lượng dung dịch sau bội phản ứng:
- TH1: hóa học tạo thành sinh sống trạng thái dung dịch:
mdd sau pư = tổng mcác hóa học tham gia
- TH2: hóa học tạo thành có chất cất cánh hơi (chất khí bay hơi):
mdd sau pư = tổng mcác chất tham gia- mkhí
- TH3: chất tạo thành tất cả chất kết tủa (không tan):
mdd sau pư = tổng mcác chất tham gia - mkết tủa
Bài tập vận dụng:
Bài tập số 1: Cho 6,5 gam kẽm phản ứng đầy đủ với 100 ml hỗn hợp axit clohiđric.
a. Tính thể tích khí hiđro thu được ở đktc ?
b. Tính nồng độ mol của hỗn hợp muối thu được sau phản bội ứng ?
c. Tính mật độ mol của hỗn hợp axit HCl đã sử dụng ?
Bài tập số 2: Hòa chảy 6 gam magie oxit (Mg
O) vào 50 ml hỗn hợp H2SO4 (có d = 1,2 g/ml) vừa đủ.
a. Tính cân nặng axit H2SO4 sẽ phản ứng ?
b. Tính độ đậm đặc % của hỗn hợp H2SO4 axit bên trên ?
c. Tính mật độ % của hỗn hợp muối sau bội phản ứng ?
Bài tập số 3: Cho 10,8 gam Fe
O công dụng vừa đủ với 100 gam dung dịch axit clohiđric.
Tuyển tập 40 bài tập Hóa học nâng cao lớp 8
Tuyển tập 40 bài tập Hóa học nâng cấp lớp 8 tổng hợp một số trong những bài tập hay và khó khăn môn Hóa lớp 8. Bài xích tập hóa học lớp 8 nâng cấp có giải mã này là tư liệu bồi dưỡng học sinh khá giỏi giành cho thầy cô và chúng ta học sinh tham khảo nhằm luyện tập cùng củng rứa lại con kiến thức. Sau đây mời các bạn tham khảo bỏ ra tiết.
Để học giỏi môn hóa học 8 cũng như đạt kết quả cao trong số kì thi, mời các bạn cùng sở hữu tài liệu chất hóa học 8 nâng cao này về ôn luyện.
Xem thêm: Review sách cà phê cùng tony cà phê buổi sáng, đọc sách truyện cà phê cùng tony
40 BÀI TẬP NÂNG CAO HOÁ 8
Bài 1. Đặt ly A đựng hỗn hợp HCl và ly B đựng dung dịch H2SO4 loãng vào 2 đĩa cân sao để cho cân ở phần cân bằng. Tiếp đến làm xem sét như sau:
Cho 11,2g sắt vào ly đựng dung dịch HCl.
Cho m gam Al vào ly đựng hỗn hợp H2SO4.
Khi cả Fe cùng Al các tan hoàn toàn thấy cân ở vị trí thăng bằng. Tính m?
Đáp án giải đáp giải chi tiết
Theo bài ra ta có:
n
Fe = 11,2/56 = 0,2 mol
n
Al = m/27 mol
Xét thí điểm 1
Phương trình làm phản ứng
Fe + 2HCl → Fe
Cl2 + H2
0,2 → 0,4 → 0,2 → 0,2 (mol)
Dung dịch sau bội nghịch ứng bao gồm chứa: Fe
Cl2 (0.2 mol) và hoàn toàn có thể có axit dư
Xét thí điểm 2
Phương trình phản ứng:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
m/27 m/54 3m/54 (mol)
Dung dịch sau phản ứng bao gồm chứa: Al2(SO4)3 hoặc hoàn toàn có thể có axit còn dư
Vì sau thời điểm phản ứng cái kim đồng hồ khối lượng vẫn ở vị trí cân bởi nên ta có thể suy luận như sau: trọng lượng kim loại Al khi bỏ vô cốc A trừ đi trọng lượng đã mất đi là khí H2 ở ly A đề xuất bằng cân nặng kim các loại Al cho vào cốc B trừ đi lượng khí H2 thoát ra ở cốc BVậy ta tất cả phương trình cân bằng trọng lượng của 2 ly như sau:
Cốc A (m
Fe - m
H2) = cốc B (m
Al - m
H2)
11.2 - 0.2.2 = m - 6m/54
48m = 583.2 => m = 12,15 (g)
Bài 2. Cho luồng khí hiđro đi qua ống thuỷ tinh chứa 20 g bột đồng (II) oxit nghỉ ngơi 4000C. Sau bội nghịch ứng chiếm được 16,8 g chất rắn.
a) Nêu hiện tượng kỳ lạ phản ứng xảy ra.
b) Tính thể tích khí hiđro gia nhập phản ứng trên sinh hoạt đktc.
Đáp án lý giải giải
a) hóa học rắn tự màu đen chuyển dần sang đỏ. Tất cả hơi nước xuất hiện.
Do bội nghịch ứng xẩy ra ko trọn vẹn nên sau pu thu được hỗn hợp gồm Cu, Cu
O
Gọi x, y theo lần lượt là số mol của Cu, Cu
O.
=> 64x + 80y = 16,8(1)
n
Cu
O ban sơ = 20/ 80 = 0,25 mol
Phương trình hóa học:
Cu
O + H2

=> n
Cu = n
Cu
O pu = x mol
=> x+y = 0,25 (2)
x= 0,2; y = 0,05
Vậy gồm 0,2 mol Cu
O phản bội ứng.
=> H = 0,2.100/0,25 = 80%
Bài 3. triển khai nung a gam KCl
O3 và b gam KMn
O4 để thu khí ôxi. Sau thời điểm phản ứng xảy ra trọn vẹn thì thấy khối lượng các chất còn sót lại sau phản ứng bởi nhau.
a. Tính xác suất a/b.
b. Tính xác suất thể tích khí ôxi tạo ra thành của hai phản ứng.
Đáp án khuyên bảo giải đưa ra tiết
a)


Ta bao gồm phương trình hóa học
2KCl
O3 → 2KCl + 3O2 (1)
2KMn
O4 → K2Mn
O4 + Mn
O2 + O2 (2)
Vì sau phản bội ứng xẩy ra thì thấy trọng lượng các chất còn lại bằng nhau nên:
Ta có:

b) vì chưng ở cùng đk thì tỉ lệ thành phần thể tích bằng tỉ lệ số mol nên:

Bài 4. mang lại luồng khí hiđro trải qua ống thuỷ tinh chứa trăng tròn g bột đồng (II) oxit sống 4000C. Sau làm phản ứng chiếm được 16,8 g hóa học rắn.
a) Nêu hiện tượng kỳ lạ phản ứng xảy ra.
b) Tính công suất phản ứng.
c) Tính số lít khí hiđro đang tham gia khử đồng (II) oxit trên làm việc đktc.
Đáp án lý giải giải đưa ra tiết
Hiện tượng bội nghịch ứng
Cu
O black sau pứ thành đỏ và bao gồm hơi nước bốc lên
b) Phương trình bội phản ứng hóa học
Cu
O + H2 → Cu + H2O
1 mol...................1 mol
x..........x.................x
n
Cu
O thuở đầu = 20/80 = 0,25 mol
Nếu Cu
O pứ không còn => n
Cu = 0,25 mol
=> m
Cu = 0,25 .64 = 16 g Cu
O dư + m
Cu = mchất rắn
⇔ (0,25−x)/80 + 64x = 16,8
⇔ x = 0,2 ⇔ x = 0,2 mol
Hiệu suất pứ:
H = 0,2/0,25.100%= 80%
c) n
H2 = n
Cu
O pứ = 0,2 mol
Bài 5. Tính tỉ lệ thể tích dung dịch HCl 18,25% (D = 1,2 g/ml) và thể tích dung dịch HCl 13% (D = 1,123 g/ml) để trộn thành dung dịch HCl 4,5 M?
Đáp án hướng dẫn giải đưa ra tiết
Gọi thể tích hỗn hợp HCl 18,25% là a (ml)
⇒ mdung dịch HCl = 1,2.a (gam)
⇒ n
HCl = (1,2a.18,25%)/36,5 = 0,006a(mol)
Gọi thể tích dung dịch HCl 13% là b (ml)
⇒ mdung dịch HCl = 1,123b (mol)
⇒ n
HCl = (1,123b.13%)/36,5 = 0,004b (mol)
Sau làm phản ứng,
Vdd = a + b (ml)=0,001a + 0,001b(lít)
⇒ CMHCl = (0,006a + 0,004b)/(0,001a + 0,001b) = 4,5M
⇒ a/b = 1/3
Bài 6. Để đốt cháy hoàn toàn 0,672 gam kim loại R chỉ cần dùng 80% lượng oxi xuất hiện khi phân hủy 5,53 gam KMn
O4. Hãy xác định kim loại R?
Đáp án khuyên bảo giải chi tiết
Phương trình bội phản ứng
2KMn
O4 → K2Mn
O4 + Mn
O2 + O2
n
KMn
O4 = 5,53/158 = 0,035 mol
=> n
O2 = 0,035/2 = 0,0175 mol
n
O2 bắt buộc dùng = 0,0175.80% = 0,014 mol
4R + n
O2 → 2R2On
=> n
R=0,014.4/n = 0,056/n mol
=> MR = 0,672:0,056/n = 12n
n = 2 => MR = 24 => R là Magie
Bài 7. Một hỗn hợp gồm Zn và fe có khối lượng là 37,2 gam. Hòa tung hỗn hợp này vào 2 lít dung dịch H2SO4 0,5M
a) Chứng tỏ rằng hỗn hợp này tung hết?
b) Nếu dùng một lượng hỗn hợp Zn và sắt gấp song trường hợp trước, lượng H2SO4 vẫn như cũ thì hỗn hợp mới này có tan hết tốt không?
c) trong trường hợp (a) hãy tính khối lượng mỗi kim loại vào hỗn hợp biết rằng lượng H2 ra đời trong phản ứng vừa đủ tác dụng với 48 gam Cu
O?
Đáp án lý giải giải chi tiết
Phương trình hóa học
Ta có MZn > MFe → Nếu các thành phần hỗn hợp toàn là Fe
→ trong 37,2g bao gồm n
Fe > n
Fe + n
Zn hay có thể nói rằng là số mol chất trong 37,2g Fe lớn hơn số gam chất trong 37,2 g hỗn hợp Fe,Zn, nếu tất cả hổn hợp toàn Fe
n
Fe = 37,2/56 = 0,66 mol
n
H2SO4 = 2.0,5 = 1 mol
Fe tác dụng với H2SO4 theo tỉ lệ thành phần 1:1
=> 37.2g fe tan hết => n
Fe H2SO4 hiện có mà n
Fe > n
Fe + n
Zn => hỗn hợp tan hết
b) trường hợp dùng gấp rất nhiều lần là 74,4g
Giả sử hỗn hợp toàn Zn → n
Zn fe +n
Zn
n
Zn = 74,4:65 = 1,14 mol > n
H2SO4 => không phản ứng hết, Zn dư mà
n
Zn fe + n
Zn => hỗn hợp không chảy hết
c. N
Cu
O = 0.6 mol
n
H2 = n
Cu
O = 0,6 mol = n
Fe + n
Zn (1)
n
Fe . 56 + n
Zn.65 = 37,2 (2)
Giải( 1 )và (2) => n
Fe =0.2 mol => m
Fe =11.2g
n
Zn = 0,4 mol => m
Zn =26
Bài 8. Để khử hoàn toàn 40 gam hỗn hợp có Cu
O với Fe2O3 ở ánh sáng cao, bắt buộc dùng 13,44 lít khí H2 (đktc).
a) Tính trọng lượng mỗi hóa học trong hỗn hợp ban đầu.
b) Tính nguyên tố % theo trọng lượng mỗi hóa học trong hỗn hợp ban đầu.
Đáp án lí giải giải bài xích tập
Cu
O + H2

Fe2O3 + 3H2 → 2Fe + 3H2O (2)Số mol H2 là 0,6 mol
Gọi số mol H2 gia nhập phản ứng một là x mol (0,6 > x > 0)
Số mol H2 gia nhập pư 2 là (0,6 − x) mol
Theo phương trình hóa học 1:
n
Cu
O = n
H2 = x (mol)
Theo phương trình hóa học 2:
n
Fe2O3 = 1/3n
H2 = (0,6 − x):3 (mol)
Theo bài trọng lượng hh là 40 gam
Ta bao gồm phương trình: 80x + (0,6−x)160 : 3 = 40
Giải phương trình ta được x = 0,3
Vậy n
Cu
O = 0,3 (mol);
n
Fe2O3 = 0,1 (mol)
n
Cu
O = 0,3 (mol);
%m
Cu
O = (0,3.80.100):40 = 60%
%m
Fe2O3 = (0,1.160.100):40 = 40%
Bài 9.
1. Đốt cháy 25,6 gam Cu nhận được 28,8 gam hóa học rắn X. Tính cân nặng mỗi hóa học trong X.
2. Cho 2,4 gam sắt kẽm kim loại hoá trị II tác dụng với hỗn hợp HCl mang dư, sau thời điểm phản ứng xong xuôi thu được 2,24 lít khí H2 (ở đktc). Xác minh kim loại.
Đáp án lí giải giải bài tập
1.
Ta có : n
Cu = 25,6/64 = 0,4 (mol)
2Cu + O2→ 2Cu
O
Theo phương trình phản ứng ta tất cả :
n
Cu
O = n
Cu = 0,4 (mol)
⇒ m
Cu
O = 0,4.80 = 32 (gam) > m
X = 28,8
Vậy X tất cả Cu
O cùng Cu(dư)
Gọi n
Cu
O = a (mol); n
Cu = b (mol)
⇒ 80a + 64b = 28,8 (1)
Bảo toàn yếu tắc với Cu, ta bao gồm :
n
Cu = n
Cu
O + n
Cu(dư)
⇒ a + b = 0,4 (2)
Từ (1) và (2) suy ra a=0,2;b=0,2a=0,2;b=0,2
⇒ m
Cu
O = 0,2.80 =16 (gam) ⇒m
Cu
O = 0,2.80 = 16 (gam)
⇒ m
Cu = 0,2.64 = 12,8 (gam) ⇒ m
Cu = 0,2.64 =12,8 (gam)
Ta có:
n
H2 = 2,24/22,4 = 0,1 (mol)
Gọi kim loại hóa trị II đề xuất tìm là R
R + 2HCl → RCl2 + H2
Theo phương trình , ta bao gồm :
n
R = n
H2 = 0,1 (mol)
⇒MR= 2,4/0,1 = 24 (g/mol)
⇒ R là sắt kẽm kim loại Magie
Bài 10. Trên 2 đĩa cân để hai cốc đựng dung dịch HCl với H2SO4 làm sao cho cân ở đoạn thăng bằng:
Cho vào cốc đựng dung dịch HCl 25 g Ca
CO3
Cho vào cốc đựng dung dịch H2SO4 a g Al.
Cân ở đoạn thăng bằng. Tính a, biết có những phản ứng xảy ra hoàn toàn theo phương trình:
Ca
CO3 + 2 HCl → Ca
Cl2 + H2O + CO2
2 Al + 3H2SO4 → Al2(SO4)3 + 3H2
Bài 12. Hòa tan hoàn toàn 6,75 gam kim loại nhôm trong hỗn hợp axit clohidric HCl dư. Phản ứng hóa học thân nhôm cùng axit clohidric HCl được màn biểu diễn theo sơ vật sau:
Al + HCl → Al
Cl3 + H2
a) Hãy lập phương trình chất hóa học của làm phản ứng.
b) Tính thể tích(ở đktc) của khí H2 sinh ra.
c) Tính khối lượng axit HCl sẽ tham gia phản ứng.
d) Tính trọng lượng muối Al
Cl3 được chế tạo ra thành.
Đáp án hướng dẫn giải bài bác tập
a) Phương trình hóa học:
2Al + 6HCl → 2 Al
Cl3 + 3H2
b) Ta có: n
Al = 6,75: 27 = 0,25 mol
Theo p.trình: n
H2 = 3/2n
Al = 3/2. 0,25 = 0,375 mol
⇒ VH2 = 0,375. 22,4 = 8,4 (lít).
c) Theo p.trình: n
HCl = 3.n
Al = 3.0,5= 0,75 mol
⇒ m
HCl = 0,75. 36,5 = 27,375g
d) Theo phương trình: n
Al
Cl3 = n
Al = 0,25 mol
⇒ m
Al
Cl3 = 0,25.133,5= 33,375g
Bài 13. a. Cho những chất: KMn
O4, CO2, Zn, Cu
O, KCl
O3, Fe2O3, P2O5, Ca
O, Ca
CO3.
Hỏi trong số các chất trên, gồm có chất nào:
Nhiệt phân nhận được O2?
a. Tác dụng được cùng với H2O, có tác dụng đục nước vôi, với H2? Viết những phương trình bội phản ứng xẩy ra (ghi rõ đk phản ứng trường hợp có).
Hãy nêu phương pháp phân biệt những dung dịch: dung dịch axit clohiđric, hỗn hợp nari hiđroxit, nước cất và muối ăn.
Bài 14. mang đến 22,4 g sắt vào một dung dịch đựng 18,25 g axit clohiđric (HCl) tạo thành thành fe (II) clorua (Fe
Cl2) cùng khí hiđro (H2)
a. Lập phương trình hoá học tập của bội phản ứng trên?
b. Chất nào còn dư sau bội nghịch ứng cùng có khối lượng là bao nhiêu?
c.Tính thể tích của khí hiđro nhận được (đktc)
Bài 15. cho luồng khí hiđro đi qua ống thuỷ tinh chứa 20 g bột đồng (II) oxit sống 4000C. Sau bội nghịch ứng nhận được 16,8 g chất rắn.
a. Nêu hiện tượng phản ứng xảy ra.
b. Tính thể tích khí hiđro tham gia phản ứng trên ngơi nghỉ đktc.
.............................
Mời các bạn tham khảo một vài tài liệu liên quan:
Trên phía trên Vn
Doc vẫn gửi tới bạn đọc Tuyển tập 40 bài bác tập Hóa học nâng cao lớp 8, giúp các bạn học sinh rèn luyện với những dạng bài xích tập cải thiện khó, chuẩn bị cho những kì thi học sinh giỏi. Để có kết quả cao hơn trong học tập tập, Vn
Doc xin ra mắt tới các bạn học sinh tài liệu chăm đề Toán 8, chuyên đề đồ vật Lý 8, chuyên đề Hóa 8, Tài liệu học tập lớp 8 mà Vn
Doc tổng hợp với đăng tải.













